光學多重成像能夠同時檢測多個生化成分并直接觀察不同的生理行為,這在生物技術和臨床醫學領域引起了廣泛關注。近紅外第二窗口(NIR-II,1000-1700 nm)下的熒光成像顯著減少了光學散射而提供了較好的空間分辨率,它推動了非侵入式活體多重成像的發展。隨著波長的延長,組織散射逐漸減少,水吸收是限制生物組織下光學穿透深度的關鍵因素。目前,僅NIR-IIb窗口(1500-1700 nm)的發光探針才能提供高分辨的活體熒光成像結果。然而,在這個狹窄的NIR-IIb區域中可用的探針數量十分有限,并且所用的熒光信號之間容易串擾重疊。因此,研究人員非常希望開發更多的發光探針來擴展優越的NIR-IIb成像窗口,增加高分辨活體多重成像中的可選通道。
為解決上述問題,復旦大學研究團隊設計了一種新型的鋰基質稀土納米核殼結構。該顆粒摻雜有稀土銩離子(Tm)和鉺離子(Er),使用1710 nm激光器能夠激發核層的Tm并傳遞給殼層的Er離子發出特征熒光,熒光光譜顯示其發射峰覆蓋了可見光和近紅外區。進一步,通過功率依賴關系曲線、拉曼散射光譜和變溫熒光光譜的結果證明了這種發射機制需要聲子輔助和激發態吸收兩個過程參與,并且熒光發射強度受基質材料的影響較大。實驗對比發現,Li基質的聲子能比Na基質更高,因而Li基質下的發光強度更高。

圖1. (a) 本工作開發的一種可被1710 nm激發產生反斯托克斯位移發光的新型稀土納米晶;
(b) 新型納米晶體在1710 nm激發下的發射光譜;
(c-e) 本工作最優結構的形貌、尺寸和元素等表征結果
本工作優化后的核殼結構顆粒具有優良的發射性能。皮下腫瘤模型的成像對比顯示,所提出的Tm@Er@LiNCs顆粒(1710 nm激發,1532 nm發射)相比于之前最長的近紅外二區反斯托克斯位移發光體系Er,Ho@Y(1532 nm激發,1180 nm發射),信噪比提升了12.7倍,這可能是由于激發光1710 nm比激發光1532 nm有更小的水吸收,使得成像信號強度更大。因而,本工作提出將這種具NIR-IIb區發射的反斯托克斯位移探針與之前報道的Er探針(Yb,Er,Ce@Y,激發:915 nm,發射:1532 nm)和Tm探針(α-Yb,Tm@Yb@Y,激發:915 nm,發射:1632 nm)等結合,進行三通道的活體多重成像。使用這三種發光納米探針可以同時點亮血管網絡、大小腸和結直腸等器官,并呈現了小鼠在清醒和麻醉狀態下的肝臟富集材料速率和腸道蠕動速率,展現了活體多重成像在臨床給藥策略方面應用的潛力。
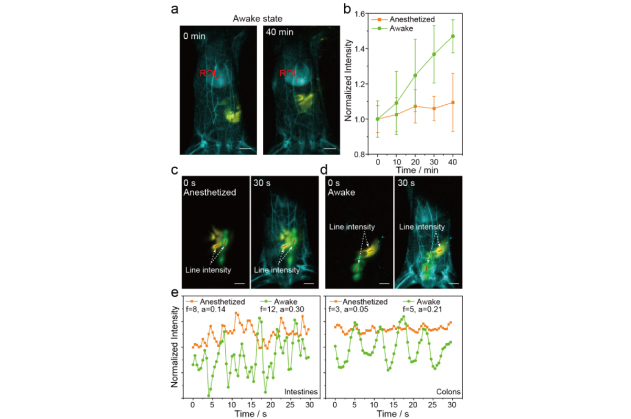
圖2. (a-b) 使用本工作開發的探針可以呈現不同生理狀態老鼠的肝臟富集的速率差異;
(c-e) 使用三種NIR-IIb的納米探針對小鼠不同生理狀態下的多重動態成像結果,提取出的熒光強度隨時間變化反映了大腸和結直腸在清醒和麻醉狀態下的蠕動差異。
總之,這是首次在NIR-IIb區內構建反斯托克斯位移發光和下轉換發光結合的多重成像模式。本工作證明了這種反斯托克斯位移發光機制兼有聲子輔助的能量轉移和激發態吸收等過程,使得其能夠發出涵蓋可見到近紅外區的發射。這種新型的反斯托克斯位移發光納米探針拓展了活體多重成像的設計思路,也將激勵廣大研究人員深入了解調控鑭系離子能級躍遷的方法。
參考文獻:
Zi-Han Chen, Baofeng Yun, Yanran Hou, Xiaohan Wang, Xusheng Wang, Jing Xu, Li Jiang, Ting Han, Hongxin Zhang*, Fan Zhang*. NIR-II Anti-Stokes Luminescence Nanocrystals with 1710 nm Excitation for in vivo Bioimaging. Angew. Chem. Int. Ed., 2024, e202416893. DOI: 10.1002/anie. 202416893.