近日,研究團隊利用超分子組裝實現近紅外納米探針在腫瘤部位的高效聚集,提高了病灶部位的成像信號。與此同時,團隊通過近紅外光調控實現在肝臟部位的可控解聚,有效降低了成像的背景信號以及顆粒沉積帶來的潛在生物毒性。
納米顆粒作為成像造影劑,可通過腫瘤部位的增強滲透與滯留效應(EPR效應)沉積在腫瘤部位。為了提高在腫瘤部位的富集,納米顆粒的體內聚集被廣泛應用于各種核磁成像、光聲成像等成像手段。然而,大部分納米顆粒在生物體內會被網狀內皮系統,例如肝臟所捕獲,并發生非特異性的聚集,這會造成過高的背景信號和不可逆的長期生物毒性。因此,納米顆粒在體內的可控解組裝是亟待解決的一個問題。
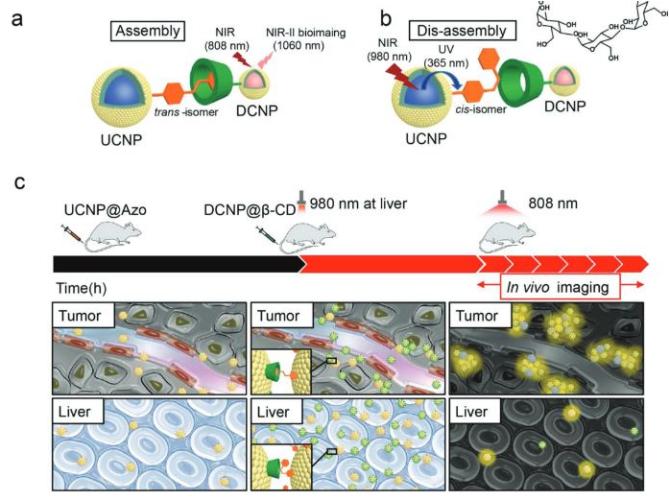
(a)納米顆粒通過偶氮苯-環糊精超分子結構聚集示意圖,下轉換納米顆粒發射的1060 nm光可用于近紅外二區成像;
(b)980 nm近紅外光介導的納米顆粒解聚示意圖;
(c)納米顆粒腫瘤部位聚集及肝臟部位解聚示意圖。
針對目前存在的問題,研究團隊利用偶氮苯-環糊精的主客體超分子結構構筑了納米顆粒體內的聚集體系,并利用穿透深度較深的近紅外光(980 nm)激發上轉換納米顆粒,使其轉換為可見光觸發偶氮苯-環糊精之間的解離,實現納米顆粒的體內解聚。同時,團隊利用近紅外第二窗口(NIR-II, 1000-1400 nm)稀土納米探針(1060 nm發射)實現了動物活體的高效成像。該體內聚集-解聚體系可被廣泛推廣至其它成像及治療領域。
參考文獻:
Mengyao Zhao, Benhao Li, Peiyuan Wang, Lingfei Lu, Zhengcheng Zhang, Lu Liu, Shangfeng Wang, Dandan Li, Rui Wang, Fan Zhang*. Supramolecularly Engineered NIR-II and Upconversion Nanoparticles In-vivo Assembly and Dis-assembly to Improve Bioimaging. Adv. Mater., 2018, 30(52), 1804982.