目前,對(duì)組織進(jìn)行切片仍為臨床醫(yī)學(xué)中診斷腫瘤的主要方法。然而在這一診斷方法的背后,卻隱藏著諸多風(fēng)險(xiǎn)與隱患。切片診斷技術(shù)不得不依賴于肉眼對(duì)腫瘤的性質(zhì)、大小與階段作出判斷,診斷結(jié)果的精確度仍不能完全保證。同時(shí),傳統(tǒng)的切片活檢過(guò)程也難以避免腫瘤細(xì)胞轉(zhuǎn)移的風(fēng)險(xiǎn)。那么,未來(lái)是否能開發(fā)一種全新的技術(shù),無(wú)需通過(guò)手術(shù)切片操作,就可以無(wú)創(chuàng)地實(shí)現(xiàn)腫瘤精準(zhǔn)診斷?
研究團(tuán)隊(duì)為以上難題的攻克提供了全新的思路與可能,提出將近紅外熒光壽命成像技術(shù)運(yùn)用于活體多重檢測(cè)當(dāng)中,有望成為一種全新的腫瘤精準(zhǔn)診斷方法。于此同時(shí)《自然·納米技術(shù)》發(fā)表了“views and news”,對(duì)該工作進(jìn)行了專題新聞報(bào)道和評(píng)述。
技術(shù)進(jìn)步:熒光成像逐步應(yīng)用于活體多重成像研究
熒光是自然界中常見(jiàn)的一種發(fā)光現(xiàn)象,可以通過(guò)熒光探針介質(zhì)來(lái)對(duì)生物體組織進(jìn)行成像檢測(cè)。熒光成像不僅具備了實(shí)時(shí)性和高空間分辨率等特點(diǎn),同時(shí)還能通過(guò)多個(gè)不同波長(zhǎng)的熒光信號(hào),以實(shí)現(xiàn)多個(gè)待測(cè)物的同時(shí)多通道檢測(cè)。熒光成像所具備的一系列優(yōu)勢(shì),使其在生命科學(xué)、藥學(xué)和醫(yī)療診斷等領(lǐng)域都有著非常廣泛的應(yīng)用前景。
在過(guò)去的工作中,研究者們主要致力于在可見(jiàn)光區(qū)(400 nm-750 nm)和近紅外第一窗口(700 nm-900 nm)內(nèi)進(jìn)行熒光成像。但由于生物體內(nèi)不同的組織(如皮膚、脂肪、骨骼等)對(duì)激發(fā)光和發(fā)射光均具有不同的散射和吸收作用,使得在這兩個(gè)區(qū)間內(nèi)的光學(xué)穿透深度和成像分辨率都比較低。這種現(xiàn)象就好比是在夜晚拿著照相機(jī)拍照,不僅難以拍清較遠(yuǎn)的物體,照片成像中的噪點(diǎn)也會(huì)格外明晰。
最近,研究者們發(fā)現(xiàn),在近紅外第二窗口區(qū)(NIR-II,波長(zhǎng)1000 nm-1700nm)內(nèi),生物組織對(duì)激發(fā)光和熒光信號(hào)的散射和吸收作用極低。光在穿透皮膚、脂肪等生物組織時(shí)的“折損率”就極大地下降了。換句話說(shuō),相比起可見(jiàn)光區(qū)和近紅外第一窗口,熒光信號(hào)在近紅外第二窗口區(qū)域內(nèi)可以更好地實(shí)現(xiàn)對(duì)生物體的深組織成像。同時(shí),生物組織在近紅外第二窗口區(qū)域內(nèi)的自發(fā)熒光效應(yīng)也較低,使生物組織內(nèi)的待檢測(cè)熒光信號(hào)較少受到來(lái)自生物組織本身的自發(fā)熒光的干擾。消除了生物組織自身的干擾因素后,成像“照片”中的“噪點(diǎn)”也就得到了顯著減少。正是在這兩大優(yōu)勢(shì)的助力下,近紅外第二窗口區(qū)域內(nèi)的熒光成像在生物組織多重檢測(cè)中有著較好的表現(xiàn)與巨大的發(fā)展前景。
然而,這一成像技術(shù)在實(shí)際的活體多重成像應(yīng)用中的效果卻往往不盡如人意。由于生命活體中各類生物組織在不同的光波段里,具有截然不同的散射和吸收“能力”,所獲得的熒光信號(hào)會(huì)隨著不同深度的組織而變化,無(wú)法有效地利用多個(gè)波長(zhǎng)來(lái)對(duì)活體中不同的分析物進(jìn)行同時(shí)定量檢出,無(wú)法實(shí)現(xiàn)活體中基于多光譜信號(hào)的多重檢測(cè)。
研究突破:利用近紅外熒光壽命為優(yōu)化腫瘤診斷提供全新可能
針對(duì)以上難題,團(tuán)隊(duì)提出了“基于時(shí)間維度的多重成像法”,利用在近紅外第二窗口區(qū)具有熒光發(fā)射的稀土納米探針熒光壽命信號(hào)來(lái)實(shí)現(xiàn)活體多重成像。
當(dāng)熒光探針被一束近紅外激光激發(fā)后,該探針吸收能量從基態(tài)躍遷至激發(fā)態(tài),偏離原有的“運(yùn)動(dòng)軌道”,再以輻射躍遷的形式發(fā)出熒光并回到基態(tài),回歸到原有的“運(yùn)動(dòng)軌道”上。當(dāng)去除激發(fā)光后,探針熒光強(qiáng)度降低到激發(fā)時(shí)熒光最大強(qiáng)度的1/e時(shí)所需要的時(shí)間即為熒光壽命。團(tuán)隊(duì)在實(shí)驗(yàn)中發(fā)現(xiàn),熒光壽命的數(shù)值具有較好的穩(wěn)定性,并不會(huì)因?yàn)樯锝M織深度的改變而隨之改變。
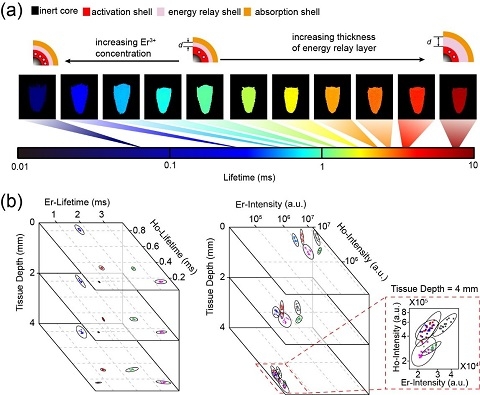
圖1:(a)不同熒光壽命的稀土納米探針在離心管中的熒光壽命的偽色彩圖。
(b)編碼小球中稀土納米探針Er發(fā)射通道和Ho發(fā)射通道的熒光壽命和熒光強(qiáng)度隨著不同厚度生物組織的變化。
有了熒光壽命這一定量后,團(tuán)隊(duì)選擇了毒性更低、扛光漂白能力更強(qiáng)的稀土納米顆粒進(jìn)行實(shí)驗(yàn)。實(shí)驗(yàn)之初,納米顆粒的合成對(duì)項(xiàng)目的進(jìn)展起到了不小阻礙。面對(duì)每次都不盡相同的合成結(jié)果,團(tuán)隊(duì)最終決定放棄已有的數(shù)據(jù)成果,全部推倒重新來(lái)過(guò)。在持續(xù)了大半年的努力下,團(tuán)隊(duì)經(jīng)過(guò)對(duì)反應(yīng)時(shí)間、反應(yīng)溫度、實(shí)驗(yàn)裝置和原料等細(xì)節(jié)的精密調(diào)控,終于克服了納米顆粒合成的技術(shù)問(wèn)題。
利用能量延遲供給以及對(duì)發(fā)光離子的濃度進(jìn)行分別調(diào)控的方法,團(tuán)隊(duì)實(shí)現(xiàn)了在單一波長(zhǎng)下對(duì)熒光壽命進(jìn)行三個(gè)量級(jí)以上的精確調(diào)節(jié)。最終,成功將這一新型成像技術(shù)應(yīng)用于乳腺癌腫瘤的精準(zhǔn)診斷,其對(duì)多個(gè)腫瘤標(biāo)志物的定量檢測(cè)結(jié)果與臨床醫(yī)學(xué)傳統(tǒng)的檢測(cè)技術(shù)獲得的結(jié)果具有高度一致性。
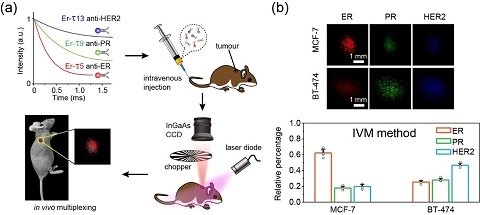
圖2:(a)小鼠實(shí)驗(yàn)的過(guò)程示意圖。
(b)對(duì)MCF-7和BT-474乳腺癌腫瘤不同標(biāo)志物的定量檢測(cè)。
相較于傳統(tǒng)臨床診斷技術(shù)一次只能對(duì)一種腫瘤標(biāo)志物進(jìn)行檢測(cè)的限制,張凡團(tuán)隊(duì)提出的時(shí)間維度成像方法可以同時(shí)定量多個(gè)腫瘤標(biāo)志物,顯著提高了檢測(cè)的效率。同時(shí),時(shí)間維度成像法還以“拍照”的形式取代了原本的活檢手術(shù),不僅可以直接避免腫瘤細(xì)胞轉(zhuǎn)移的風(fēng)險(xiǎn),同時(shí)降低了傳統(tǒng)方法在組織切片、處理和評(píng)分過(guò)程中可能造成的人為誤判風(fēng)險(xiǎn),有望成為一種新型的無(wú)創(chuàng)腫瘤診斷方法。
參考文獻(xiàn):
Yong Fan, Peiyuan Wang, Yiqing Lu*, Rui Wang, Lei Zhou, Xianlin Zheng, Xiaomin Li, James A. Piper and Fan Zhang*. Lifetime-engineered NIR-II Nanoparticles Unlock Multiplexed in Vivo Imaging. Nat. Nanotechnol., 2018, 13(10), 941-946.