熒光成像技術在生命科學基礎研究中具有廣泛應用,并在生物醫學應用等領域展現出良好的應用前景。近年來爆炸式增長的臨床前和臨床試驗項目足以體現生物醫學熒光成像的重要性。相比于可見光,近紅外熒光(NIR, 700-1700 nm)成像具有更強的光學組織穿透能力和更低的生物自發背景熒光干擾,因而能夠提供更高的活體成像對比度,實現更靈敏、更準確的活體檢測。近年來,復旦大學化學系張凡教授課題組在提高熒光成像對比度、實現深層組織精確熒光成像方面做出了許多貢獻,例如,開發長波長的近紅外二區稀土離子-分子配合物(Nat. Mater. , 2021, 20, 1571.)、實現近紅外二區長余輝活體熒光成像(Nat. Nanotechnol. , 2021, 16, 1011)、近紅外二區生物熒光成像(Nat. Commun., 2020, 11, 4192)、近紅外二區熒光壽命活體成像(Nat. Nanotechnol., 2018, 13, 941)等。2023年1月,Nature Reviews Bioengineering雜志正式在線發表了復旦大學化學系張凡教授研究團隊綜述文章“Near-infrared luminescence high-contrast in vivo biomedical imaging” (圖1)。以提高活體熒光成像對比度為主線,該綜述系統回顧了近紅外熒光成像技術在生物醫學應用領域發展過程中面臨的問題并總結了相應的解決思路與領域發展現狀。
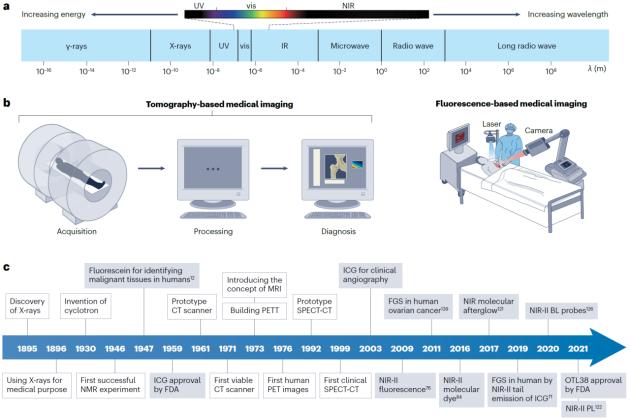
圖1. 臨床醫學影像與熒光成像技術的發展
01熒光成像技術面臨的挑戰
熒光成像是生物醫學檢測模式中最簡便且具有靈活性的手段,熒光染料的快速發展也促進了多通道復合信號的快速實時檢測,使其在生物醫學應用中更具有吸引力。近紅外活體熒光成像技術近年來發展迅速,但仍面臨著多種問題,其真正應用于臨床影像和檢測的實例并不多。這些問題主要來源于熒光或熒光分子與生物組織的相互作用,導致熒光成像對比度降低。生物組織并不透明,熒光在穿透生物組織過程中與組織和細胞相互作用,發生光子反射、吸收、散射等過程,造成熒光信號的衰減(圖2)。組織對熒光尤其是波長為400-700 nm的可見光有明顯的削弱作用,并且這一作用是雙向的,即激發光和發射光都會在組織中衰減。于此同時,生物組織有含有發色團的生物大分子組成,這些生物大分子在受激發光照射時,通常會產生熒光發射,稱為自發熒光,由此造成熒光成像的背景干擾(圖2)。另一方面,熒光成像對比度也取決于熒光探針在目標組織的靶向和富集效率。人體具有非常完善的免疫防護機制能夠清除注射的外源物質。盡管已有許多研究已經報導利用特殊的配體修飾可以減少探針表面的蛋白吸附,從而減少被免疫系統識別清除。然而,配體修飾方法不能完全避免宿主清除,大多數的探針依然能夠被單核巨噬系統識別和捕獲。此外,人體不同的器官各自具有特殊的微觀結構,對各種具有不同的理化性質探針(尤其是納米探針)具有選擇通過性。熒光成像技術在臨床應用受限很大程度上也歸因于目前所批準的探針分子在活體中靶向效率欠佳(圖3)
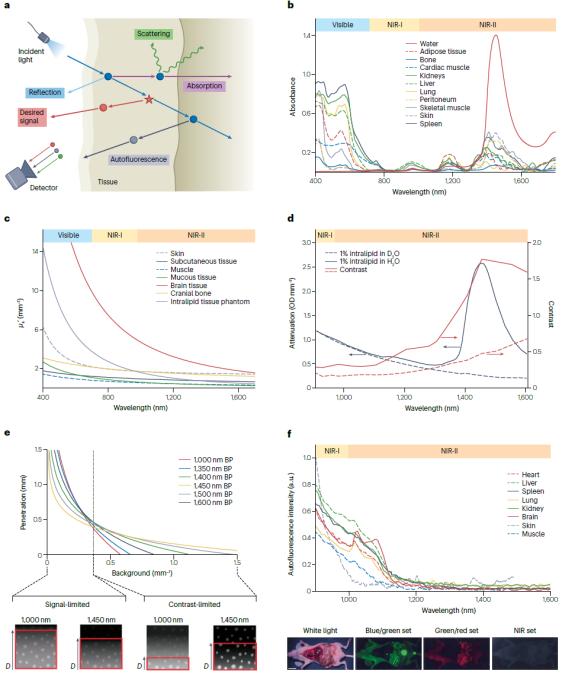
圖2. 熒光在組織中的衰減與自發熒光
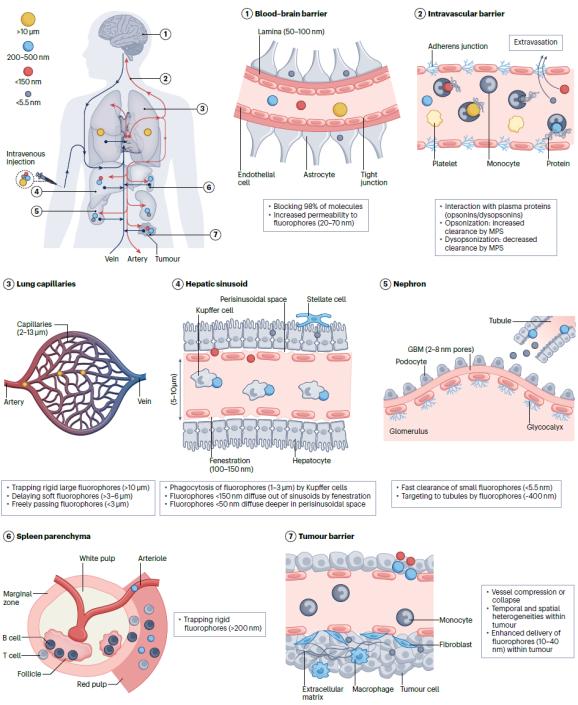
圖3. 注射熒光探針在活體中的運輸屏障
02提高熒光成像對比度的途徑
1.優化熒光探針的光學性能l熒光波長活體成像的熒光信號實際是從組織內部產生而非機體表面,根據成像位置的不同,熒光探針通常聚集在組織內部距離表面深度從微米到厘米不等。平均自由光程(Transport Mean Free Path,TMFP)描述了光子在組織中沿直線傳播的距離,熒光在組織中的極限穿透深度可以由TMFP表述,超過TMFP的熒成像會導致圖像對比度低并且信號讀出不準確。近紅外光(NIR, 700-1700 nm)由于組織吸收和散射低,相比可見光,具有更深的穿透深度。在相同的生物組織中,可見光穿透深度僅能達到微米級,而近紅外光則可以達到毫米甚至厘米級。此外,由于生物組織在近紅外窗口的自發熒光強度顯著降低,因此,近紅外窗口的熒光成像的背景更低,能夠實現更高的對比度。尤其是近紅外第二窗口(NIR-II, 1000-1700 nm)成像,可以實現迄今最高的熒光成像對比度(圖4)。近年來,多種具有良好光學性能的NIR-II納米熒光探針被設計并用于活體成像。例如,單壁碳納米管(SWCNTs)、量子點(QDs)、鑭系下轉換納米顆粒(LnNPs)和金納米顆粒(AuNPs)等。然而,無機納米顆粒由于不可生物降解,在人體內的長期毒性仍然未知。為了解決這一安全顧慮,研究者們開發了具有NIR-II發射的有機分子熒光探針(圖1.11)。盡管分子探針還不能取得與NIR-II無機納米顆粒相媲美的成像效果,但已開發的NIR-II有機熒光分子,如CH1055、FD1080和LZ1105已經在小鼠活體成像中展現出了比臨床批準的ICG更好的熒光成像效果。
l熒光亮度亮度較低的熒光探針使用時需要更高的注射劑量、更大的激發功率或更長的曝光時間,因而可能會導致更大的毒副作用、產生超出人體耐受范圍的熱負荷或丟失成像過程中的動態信息。反之,亮度高的熒光探針具有更深的成像穿透深度,并且低激發光功率有助于削弱背景信號,能實現更高的成像對比度對于無機納米顆粒,由于發光機理不同,無機納米材料的亮度通常由顆粒的尺寸、摻雜劑、晶相、配體或剛性等因素決定。在納米結構中引入核殼結構來減少水分子對熒光的淬滅作用是一種對大多數納米顆粒通用的亮度提升策略。與有機熒光分子相比,無機納米材料通常有較高的量子產率和優越的光穩定性。但是對于NIR有機分子探針,由于其長波長通常來源于分子內較大的共軛平面結構,這也導致了分子在水溶液中穩定性差、亮度低等問題。一方面,可以通過在分子中引入空間位阻來減少分子間的相互作用以提高熒光分子的亮度。例如,在分子側鏈中通過共價鍵引入基團增大熒光團位阻,或者利用蛋白質包裹疏水的熒光團,通過超分子相互作用形成穩定的蛋白質-熒光分子復合物。
l熒光斯托克斯位移斯托克斯位移的存在決定了熒光成像技術中探針內在的二次濾波效應,有助于實現更高的成像對比度。探針具有較小的斯托克斯位移會導致發射光子被分子重吸收并,由此導致分子熒光的自猝滅。此外,由于激發光譜和發射光譜的重疊會導致有激發光和散射光引起的相關檢測誤差,降低檢測靈敏度和成像對比度。探針具有較大的斯托克斯位移可以避免熒光串擾,簡化信號區分,更易實現多色成像。在對深部組織進行熒光成像時,斯托克斯位移的作用尤其明顯。病變深度的變化對斯托克斯位移小的熒光探針有較大的影響。對于淺表組織的熒光成像,斯托克斯偏小(< 50 nm)但亮度高的熒光團可以展現更高的成像對比度。相反,對全身或深層組織成像時,斯托克斯位移較大的探針(>100 nm)更具有優勢。這主要是由于激發光在穿透厚組織時產生的背景熒光,小斯托克斯位移的探針由于內在濾波效果差,產生的反射和散射光子容易造成強烈的干擾信號。
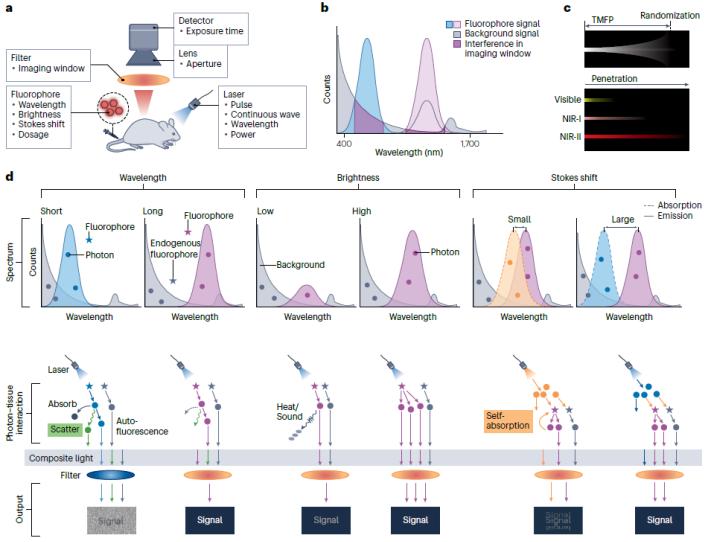
圖4. 優化熒光探針性能
2.降低活體組織熒光背景傳統的熒光成像技術需要實時的光激發,不可避免地導致了激發光散射和組織自發熒光。當濾光片能有效地濾過散射光,則散射光對成像對比度的干擾很小,但實際應用過程中光學元件濾光效率難以達到100%。盡管組織散射和自發熒光在近紅外窗口的影響相比可見區有明顯衰減,但它們對成像對比度和檢測靈敏度的影響不可忽視,因此在生物醫學應用中需要加以考慮和應對。近年來發展的無背景成像技術有效降低了成像背景干擾問題。這些技術大體上可以分為以下三類(圖5):
l延遲熒光成像通過調制檢測器和激光脈沖可以在去除激光光源后獲得探針的部分熒光信號。這種策略也被稱為時間門控成像技術。該技術成像對比度與熒光信號采集時間窗口有關,并隨著延遲時間的延長而增加,當組織自發熒光完全衰減后可以實現最大成像對比度。因此,延遲熒光成像的對比度取決于熒光探針與組織自發熒光之間的壽命差距,探針的熒光壽命越長,越容易實現高對比度成像。延遲熒光成像技術中引入約1 μs的延遲時間,就能夠完全消除組織的近紅外自發熒光。一種極限長壽命發光現象,長余輝發光(PL),指在停止激發后熒光可以持續數分鐘或數小時的光學現象。長余輝成像與時間門控熒光成像在方法上的區別在于前者不需要調制檢測器和激發脈沖。應用近紅外PL活體成像相比于傳統基于實時激發的近紅外熒光成像方法,其成像對比度可以提高幾十至幾百倍。
l自發光成像生物發光(BL)存在于魚類、昆蟲、藻類和植物中,是酶催化氧化發光前驅體并釋放光子的現象。由于不需要激發光,成像背景幾乎為零,已被廣泛應用于細胞作用、蛋白質相互作用、感染和腫瘤等研究領域。天然的生物發光底物熒光波長在可見區,這一波段的熒光容易被組織吸收和散射,所以穿透深度有限。因此,改造生物發光底物使之波長紅移到NIR窗口,增強生物發光的穿透深度,對于活體成像的實際應用具有重要意義。另一方面,化學發光(CL)成像技術應用與生物發光類似。化學發光是化學反應過程中產生的熒光發射現象。化學發光由于獨特的發光機制(氧化還原反應),可以用于檢測病變組織中過表達的活性氧(ROS)、活性氮(RNS)。與傳統的激發熒光成像不同,化學發光可以在檢測病灶原位生成,因而不受激發光漂白和背景干擾影響,具有比傳統熒光成像更高的檢測靈敏度和成像對比度。將自發光(BL、CL)底物與NI熒光分子混合包裹成膠束,使之形成生物熒光共振能量轉移(BRET),將生物發光波長延長到近紅外區可以進一步提高熒光穿透深度和成像對比度。
l使用其他激發光源生物自發熒光來源于短波長光子與生物組織的相互作用。利用激光器之外的其他特殊光源可以減少這一現象從而降低生物背景熒光。例如,X-射線可以自由地穿透生物組織而不會引起散射和組織自發熒光。利用X-射線激發熒光探針使之發出近紅外熒光進行生物檢測,可以同時實現更深的組織穿透深度和更低的熒光背景信號。除X-射線外,切倫科夫輻射(CR)也可作為激發源用作熒光成像。PET成像用到的核素,例如18F、64Cu、68Ga、89Zr、90Y能夠發射β-粒子并發射出藍色的光,即切倫科夫光。但由于切倫科夫光波長短,直接應用于熒光成像時組織穿透能力差,且在組織中造成了自發熒光背景,很難用于實際活體檢測或手術導航。因此利用切倫科夫共振能量轉移(CeRET)策略,將核素與近紅外熒光探針結合,將切倫科夫光的波長延伸到近紅外區以提高其組織穿透能力。在這種共振能量轉移系統中,切倫科夫光扮演了原位激發的角色,相比于利用外置光源激發,這種原位激發策略不存在入射光衰減的影響。此外,由于熒光檢測器使用更靈活、更經濟,開發便攜式的熒光檢測器代替PET成像儀器能夠使疾病篩查更簡便、成本更低。
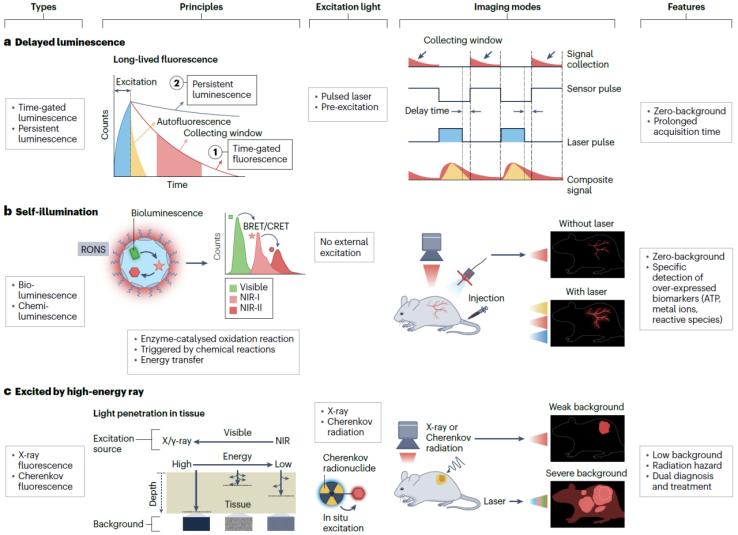
圖5. 無背景熒光成像技術
3.局部組織成像靜脈注射造影劑是體內發光成像最常用的給藥方法。但大多數探針可能會被免疫系統識別捕獲,造成嚴重的背景信號并降低成像對比度。
l調節探針的生物分布帶有特定靶向配體的探針可以靶向到細胞表面的受體,特異性配體如葉酸、葡萄糖、前列腺特異性膜抗原、多肽、適配體、抗體或蛋白等常被修飾在分子或納米探針的表面以實現腫瘤靶向。除了利用靶向配體修飾探針外,還可以通過改變探針理化性質來調控探針在活體中的代謝和分布(圖6)。例如,對于無機納米探針,超小納米顆粒(<5.5 nm)可以快速被腎臟清除,因此可以用來評估腎小球濾過率。通過改變有機分子探針的取代基團可以改變其在活體中的代謝與分布,從而調控組織中的熒光信號分布及成像對比度。例如,設計分子結構使其特異性分布在小鼠的甲狀腺、甲狀旁腺、外周神經纖維、腎臟、腎上腺、腦垂體、骨頭、胰腺、淋巴結和腫瘤等。
l針對局部組織進行特殊處理對成像組織進行特殊預處理其目的一為提高熒光探針在局部成像組織中的富集濃度。一方面,由于單核吞噬細胞系統對外源藥物的清除有一個劑量閾值,超過這一閾值上限以外的顆粒能夠避免被Kupffer細胞捕獲。目前有多種材料包括碳納米顆粒(20-50 nm)、硫酸葡聚糖、氯化釓和氯膦酸脂質體等,被證明能夠用于預注射以使MPS達到飽和狀態,從而阻斷MPS對熒光探針的捕獲,提高藥物的被動靶向效率。另一方面,另外,也可以利用超聲和微氣泡形成的刺激擴大血管內皮細胞間隙,增加腦血管或腫瘤血管的通透性以提高探針靶向效率。其目的二為降低局部組織的熒光背景。光學清除技術(又稱光學透明技術)可以去除組織中的脂質和水分子等,使組織吸收和散射大大減少,同時輔助以匹配組織與成像環境的折射率,能夠降低組織的背景熒光并提高光的穿透深度和成像對比度。在活體中實現光學透明需要有高度安全性和生物相容性,因此透明過程必須具有可逆性。活體中使用的清除劑僅局限于生物相容性好的水溶液,如甘油、乙二醇、醋酸、糖、聚乙二醇和丙二醇等。
l可激活型熒光探針激活型探針的設計需要必須包含能夠響應外環境刺激的結構,能在特定的生物標志物如金屬離子、酶、氧化還原環境或其他生物分子存在的條件下發生反應和結構變化,并體現出熒光強度、波長或壽命等方面的顯著改變。由于探針通常也會在正常組織中滯留并造成背景信號,為了提高成像對比度,需要等待探針從正常組織中被清除之后才能更好地顯示病變組織和健康組織之間的區別。相比之下,可激活型熒光探針僅在含有特異的或過表達的生物標志物的病變組織中顯示信號變化。目前研究較多的是基于熒光發射強度變化的激活型熒光探針,例如,利用腫瘤微環境的偏酸性條件來激活熒光探針,實現熒光從“關”到“開”的轉變。這類熒光探針通常在血液中處于淬滅狀態,但在到達腫瘤部位后發生分解或結構變化,同時伴隨著熒光強度的顯著提升。臨床上目前也正在嘗試利用腫瘤部位的酸激活策略來提高成像對比度。
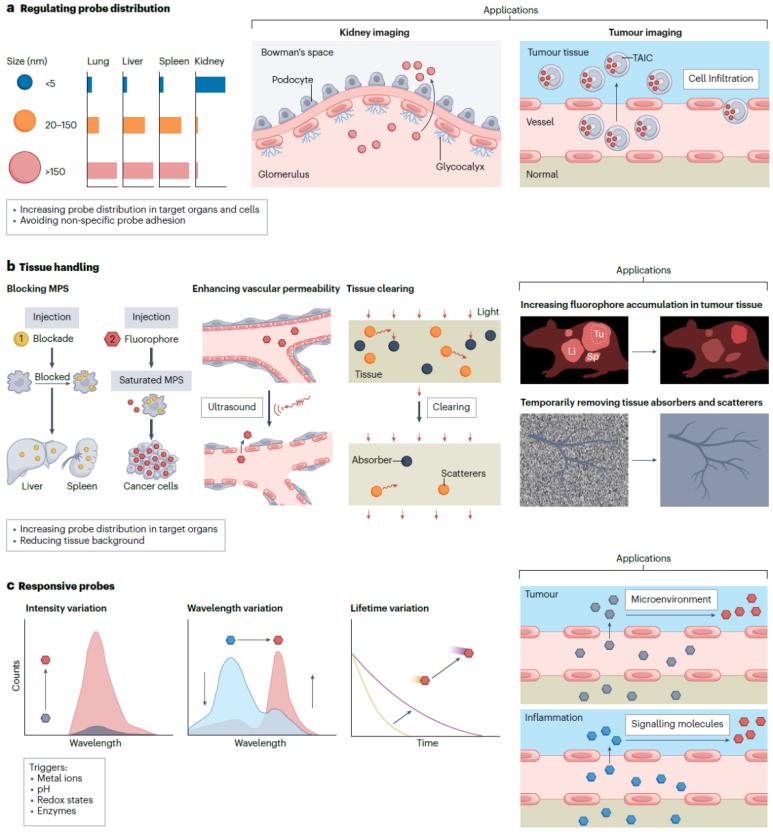
圖6. 局部組織成像
03 總結與展望
目前近紅外熒光成像的臨床試驗主要聚焦在具有靶向性的NIR-I染料,如用ICG和IRDye 800CW標記的生物分子等。NIR-II窗口的發現促進了熒光探針的進一步發展,在優化探針結構的同時,檢測器的發展也需要齊頭并進。此外,隨著生物工程與基因編碼技術的進步,發現并解碼近紅外自發光蛋白或能推動高對比度熒光成像與光遺傳學的快發展。
參考文獻:
Ying Chen, Shangfeng Wang and Fan Zhang*, Near-infrared luminescence high-contrast in vivo biomedical imaging, Nature Reviews Bioengineering, 2023, 1, 60–78