近日,本文利用近紅外探針實(shí)現(xiàn)近紅外二區(qū)熒光成像導(dǎo)航卵巢癌實(shí)體瘤和轉(zhuǎn)移灶的精準(zhǔn)切除,此方法有望在臨床上用于腹腔惡性轉(zhuǎn)移腫瘤的精準(zhǔn)手術(shù)導(dǎo)航。
手術(shù)切除通常是惡性腫瘤最常見和最有效的治療方法之一。然而外科醫(yī)生觸診和目視檢查并不足以確保區(qū)分惡性和正常的組織類型,因此可能導(dǎo)致不完全切除或健康組織不必要切除。相比于術(shù)前影像學(xué)檢查及手術(shù)中視覺檢查及觸診,活體熒光成像技術(shù)由于其即時(shí)性、高分辨率、高特異性等檢測(cè)優(yōu)勢(shì),為精準(zhǔn)手術(shù)導(dǎo)航技術(shù)領(lǐng)域提供了較好的應(yīng)用前景。傳統(tǒng)的可見光區(qū)(400 - 750 nm)和近紅外一區(qū)(NIR-I, 750 - 900 nm)熒光,由于其組織穿透深度較淺和嚴(yán)重的自體熒光干擾,極大地限制了熒光成像技術(shù)在腹腔以及淋巴結(jié)轉(zhuǎn)移病灶在手術(shù)導(dǎo)航中的應(yīng)用。此外,手術(shù)切除過程中需要熒光探針具有長效的腫瘤內(nèi)滯留時(shí)間和光穩(wěn)定性。
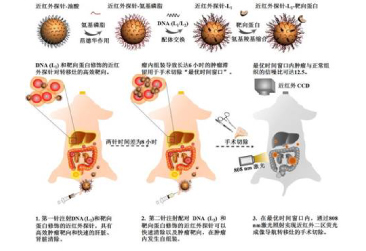
圖1. 表面分別修飾配對(duì)DNA(L1/L2)和修飾靶向蛋白的近紅外探針。 對(duì)于這兩種配對(duì)DNA修飾的探針采用兩針注入法,通過肝臟、腎臟的快速代謝,體內(nèi)正常組織的熒光信號(hào)可以降到最低;腫瘤內(nèi)的探針自組裝可以對(duì)腫瘤實(shí)現(xiàn)長達(dá)6小時(shí)的穩(wěn)定標(biāo)記,確保精準(zhǔn)的手術(shù)導(dǎo)航。
針對(duì)上述兩個(gè)問題,研究團(tuán)隊(duì)利用近紅外二區(qū)熒光探針(NIR-II, 1000 - 1700 nm)的深組織穿透和低自體熒光優(yōu)勢(shì),結(jié)合化學(xué)自組裝設(shè)計(jì)實(shí)現(xiàn)了探針在腫瘤內(nèi)的長期穩(wěn)定標(biāo)記,極大地提高了光學(xué)成像的信噪比。初步實(shí)現(xiàn)了卵巢癌腹膜轉(zhuǎn)移以及淋巴結(jié)轉(zhuǎn)移腫瘤在熒光成像指導(dǎo)下精準(zhǔn)切除(圖1),為該技術(shù)的臨床轉(zhuǎn)化應(yīng)用提供了可能。
參考文獻(xiàn):
Peiyuan Wang, Yong Fan, Lingfei Lu, Lu Liu, Lingling Fan*, Mengyao Zhao, Yang Xie, Congjian Xu, and Fan Zhang*. NIR-II Nanoprobes In-vivo Assembly to Improve Image-guided Surgery for Metastatic Ovarian Cancer. Nat. Commun., 2018, 9, 2898.