近日,研究團隊利用超分子組裝實現(xiàn)近紅外納米探針在腫瘤部位的高效聚集,提高了病灶部位的成像信號。與此同時,團隊通過近紅外光調(diào)控實現(xiàn)在肝臟部位的可控解聚,有效降低了成像的背景信號以及顆粒沉積帶來的潛在生物毒性。
納米顆粒作為成像造影劑,可通過腫瘤部位的增強滲透與滯留效應(yīng)(EPR效應(yīng))沉積在腫瘤部位。為了提高在腫瘤部位的富集,納米顆粒的體內(nèi)聚集被廣泛應(yīng)用于各種核磁成像、光聲成像等成像手段。然而,大部分納米顆粒在生物體內(nèi)會被網(wǎng)狀內(nèi)皮系統(tǒng),例如肝臟所捕獲,并發(fā)生非特異性的聚集,這會造成過高的背景信號和不可逆的長期生物毒性。因此,納米顆粒在體內(nèi)的可控解組裝是亟待解決的一個問題。
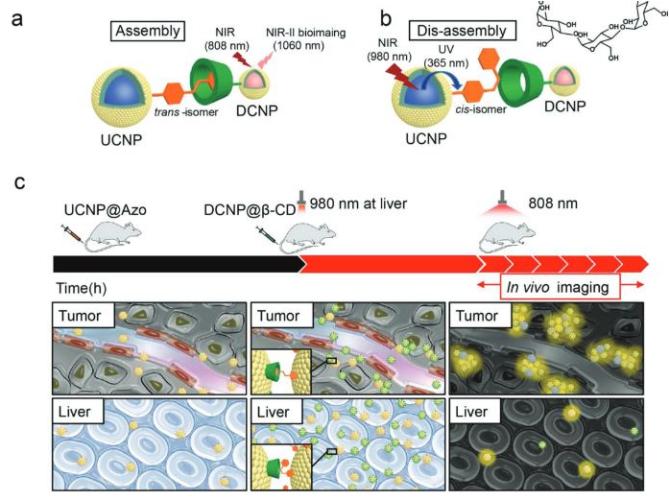
(a)納米顆粒通過偶氮苯-環(huán)糊精超分子結(jié)構(gòu)聚集示意圖,下轉(zhuǎn)換納米顆粒發(fā)射的1060 nm光可用于近紅外二區(qū)成像;
(b)980 nm近紅外光介導(dǎo)的納米顆粒解聚示意圖;
(c)納米顆粒腫瘤部位聚集及肝臟部位解聚示意圖。
針對目前存在的問題,研究團隊利用偶氮苯-環(huán)糊精的主客體超分子結(jié)構(gòu)構(gòu)筑了納米顆粒體內(nèi)的聚集體系,并利用穿透深度較深的近紅外光(980 nm)激發(fā)上轉(zhuǎn)換納米顆粒,使其轉(zhuǎn)換為可見光觸發(fā)偶氮苯-環(huán)糊精之間的解離,實現(xiàn)納米顆粒的體內(nèi)解聚。同時,團隊利用近紅外第二窗口(NIR-II, 1000-1400 nm)稀土納米探針(1060 nm發(fā)射)實現(xiàn)了動物活體的高效成像。該體內(nèi)聚集-解聚體系可被廣泛推廣至其它成像及治療領(lǐng)域。
參考文獻:
Mengyao Zhao, Benhao Li, Peiyuan Wang, Lingfei Lu, Zhengcheng Zhang, Lu Liu, Shangfeng Wang, Dandan Li, Rui Wang, Fan Zhang*. Supramolecularly Engineered NIR-II and Upconversion Nanoparticles In-vivo Assembly and Dis-assembly to Improve Bioimaging. Adv. Mater., 2018, 30(52), 1804982.