本文利用谷胱甘肽修飾的超小稀土納米顆粒進行活體內原位響應活性氧物種聚集,實現了炎癥部位快速穩定的近紅外二區成像。
納米探針作為成像造影劑,可通過病灶部位的增強滲透與滯留效應(EPR效應)沉積在腫瘤、炎癥等部位。為了提高在病灶部位的富集,納米探針在體內響應病灶微環境的選擇性聚集被廣泛應用于活體成像領域。然而,大部分具有微環境響應性聚集能力的納米顆粒需要復雜的表面官能化修飾。此外,如果納米顆粒的水合粒徑較大(大于5.5 nm),在生物體內會被肝臟捕獲,造成過高的背景信號和不可逆的長期生物毒性。相反,超小尺寸的納米顆粒可以通過腎臟快速清除出體外,因此,具有環境特異響應性的超小納米顆粒的合成及應用是亟待解決的一個問題。
針對目前存在的問題,團隊合成了超小粒徑的近紅外二區稀土發光納米顆粒(5.3 nm),并利用生物內源性小分子谷胱甘肽對其進行表面修飾。這類超小納米探針可以在活體內炎癥部位響應過量的活性氧物種,快速發生原位聚集,從而使探針獲得較高的富集量及穩定的近紅外二區成像信號(尾靜脈注射后10分鐘炎癥部位可以觀察到明顯信號增強,信號穩定長達8小時)。該體內原位響應微環境聚集體系可被廣泛推廣至其他成像探針的設計及應用領域。
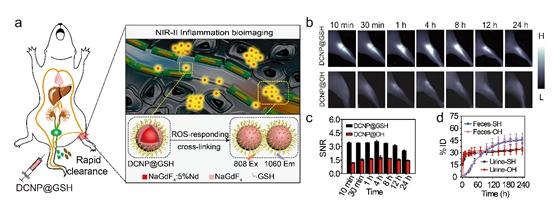
圖1. (a)谷胱甘肽修飾的超小稀土納米顆粒在炎癥部位響應活性氧物種原位聚集的示意圖。
(b)對比活性氧惰性相應的表面修飾基團,谷胱甘肽修飾的超小探針可以對表皮急性炎癥進行快速穩定的成像檢測。
(c)實驗組納米顆粒在炎癥成像過程中信噪比明顯高于對照組。
(d)實驗組與對照組納米探針在靜脈注射后十天內的代謝情況。
參考文獻:
Mengyao Zhao+, Rui Wang+, Benhao Li, Yong Fan, Yifan Wu, Xinyan Zhu and Fan Zhang*. Precise in vivo Inflammation Imaging Using in‐situ Responsive Cross‐linking of Glutathione Modified Ultra‐Small NIR‐II Lanthanide Nanoparticles. Angew. Chem. Int. Ed., 2019, 58(7), 2050-2054.